JP모건 컨퍼런스(JPM) 2021에서 CRISPR 기반의 치료제 개발회사 에디타스 메디신(Editas medicine)과 빔 테라퓨틱스(Beam therapeutics)가 회사의 치료제 개발 현황에 대해 발표했다. 두 회사 모두 겸상적혈구병 및 베타지중해빈혈, 안과질환, 암(CAR-T) 등 비슷한 분야의 크리스퍼 치료제를 개발하고 있다. 겸상적혈구병이나 베타지중해빈혈은 유전자변이로 생기는 질환 중 가장 흔한 질환에 속하기 때문에 치료제에 대한 수요가 크다. 안과질환은 안구라는 특정 장소를 타깃하기 좋고, CAR-T는 항암제 분야에서도 워낙 유망한 분야다.
두 회사는 크리스퍼를 이용한 치료제로 비슷한 질환을 타깃하고 있었지만 전략 및 치료제 개발 상황은 달랐다. 두 회사를 통해 크리스퍼 기술의 현 개발 상황과 전략에 대해 알아보자.
◆'in vivo' CRISPR의 선구자 에디타스
에디타스는 JPM에서 크리스퍼 치료제 '첫 in vivo’ 임상의 진행상황에 대해 발표했다. 에디타스는 작년 초 희귀 안과질환인 레베르 선천성 흑내장(Leber Congenital Amaurosis 10, LCA10)의 in vivo 크리스퍼 치료제 ‘EDIT-101’ 임상을 시작했다.
크리스퍼 유전자치료제는 대부분 ex vivo로 개발된다. ex vivo 방식은 환자로부터 유전자를 전달하려는 세포를 채취해 유전자치료제를 주입한 후 다시 환자에게 투여하는 방식이다. 따라서 ex vivo 방식은 유전자치료제 제조 및 치료 과정이 복잡하다. 하지만 유전자 치료제를 직접 환자 몸에 주입하는 in vivo 유전자치료제보다 타깃을 더 명확히 할 수 있고, 전달체에 대한 면역반응을 낮출 수 있어 안전성 측면에서는 ex vivo가 더 낫다고 여겨진다. 이에 에디타스는 치료방식이 간편하면서도 '안전성도 갖춘' in vivo 크리스퍼 치료제 개발을 진행중이며 이 분야에서 가장 앞서있다.
EDIT-101은 에디타스의 리드프로그램으로 CRISPR/Cas9을 이용한 LCA10 치료제 후보물질이다. LCA10은 CEP290 단백질을 코딩하고 있는 유전자의 변이로 나타나는 안과질환이다. CEP290에 변이가 생기면 광수용체의 외절(outer segment)부분이 잘 형성되지 못해 심할 경우 실명까지 유발한다. 신디 콜린스(Cindy Collins) 에디타스 CEO는 “작년 첫 코호트의 투약을 모두 마쳤다”며 “임상의 1차 종결점은 안전성이고 2차 종결점은 효능”이라고 말했다.
신디 콜린스의 발표에 따르면 EDIT-101 임상 1상(NCT03872479)은 5개의 코호트로 나누어 진행하고 있으며 환자들은 EDIT-101을 망막하 주사(subretinal injection)로 1회 투약 받는다. 성인 환자 2명을 대상으로 한 저용량 코호트의 투약을 마쳤으며 아직까지 심각한 부작용이나 용량제한 독성반응(dose limiting toxicity) 등 안전성에 대한 이슈는 나타나지 않았다. 1번 코호트에 참여한 2명의 환자는 투약 후 각각 9개월, 3개월이 지났고, 각 기간에 대한 안전성 결과를 확보할 수 있었다.
긍정적인 임상 진행상황을 바탕으로 에디타스는 성인 환자 4명을 대상으로 한 EDIT-101 중간용량 투여군인 두번째 코호트 투약을 올해 1분기에 시작할 예정이다. 또한 올해 말에 EDIT-101 임상 결과를 공개할 계획이다.

▲EDIT-101 임상 1상 안전성 데이터 (에디타스 발표자료)
에디타스는 EDIT-101 외에도 안과질환에서 어셔증후군 2a형(Usher syndrome 2a) 치료제 후보물질 ‘EDIT-102’와 망막색소변성증 4(Retinitis Pigmentosa 4, RP4)에 대한 치료제 개발을 진행하고 있다. 특히 신디 콜린스는 “EDIT-102는 EDIT-101과 유전자 편집 시스템이 거의 비슷하기 때문에 개발 진행이 빠를 것”이라고 말했다. 또한 올해 말까지 RP4 치료제 후보물질을 선정할 것이라고 했다.
에디타스는 이상헤모글로빈증(hemoglobinopathy)과 암 분야에서는 CRISPR/Cas12a를 이용한 Ex vivo 치료제를 개발하고 있다. 에디타스는 JPM 발표 당일(13일, 현지시간) FDA로부터 겸상적혈구병(Sickle cell disease) 크리스퍼 치료제 후보물질 'EDIT-301'에 대해 임상 허가를 받았다고 밝혔다. 이에 에디타스는 두개의 파이프라인을 임상 단계로 진입시켰다. 또한 세번째 임상 진입을 위해 EDIT-301의 베타지중해빈혈(Beta thalassaemia) IND도 올해 안에 제출할 예정이다.
고형암 치료제 개발을 위해서 에디타스는 여러가지 유전자를 편집한 iPSC 기반의 NK(iNK)세포 치료제 개발을 하고 있다. 신디 콜린스는 “iNK cell이 앞으로 면역항암제의 미래가 될 것이라 생각한다”며 “NK세포의 장점과 유전자 편집으로 다양한 기능을 추가한 면역항암제를 개발할 수 있다”고 말했다.
또한 에디타스는 다양한 파트너십을 통해 크리스퍼 치료제 기술을 발전시키고 있다. 애스크바이오(Askbio)와 맺은 유전자 치료제 전달에 필요한 AAV 캡시드 개발 파트너십으로 맺었고, 블루락(blue rock)과의 파트너십으로 iPSC 세포주를 이용할 수 있게 됐다.
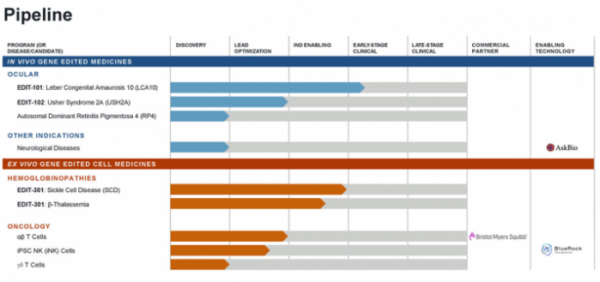
▲에디타스(Editas medicine) 파이프라인 (에디타스 발표자료)
◆CRISPR의 장점을 이용한 빔(Beam)의 'base editing'
존 에반스(John Evans) 빔 CEO는 “크리스퍼, 징크핑거, 테일 등의 핵산분해효소를 이용한 유전자 치료제는 타깃 능력은 좋지만 유전자 편집 능력에는 한계가 있다. 빔의 ‘base editing(염기 편집)’은 주변의 다른 시퀀스에 영향주지 않으면서 연필로 쓴 글자를 지우고 수정하듯이 원하는 한 염기(base)만 지우고 바꿀 수 있다"며 “빔은 크리스퍼의 장점인 좋은 타깃 능력에 DNA 손상이 없는 염기 편집 기술을 적용시켰다”고 말했다.
빔의 염기 편집 단백질은 크게 두 도메인으로 나뉜다. 첫번째 도메인인 크리스퍼 단백질은 ‘Guide RNA’를 이용해 유전자 편집이 필요한 곳을 타깃해 결합한다. 타깃에 결합한 기존 크리스퍼 단백질은 dsDNA를 손상(break)시켜 유전자 편집을 시작하지만 빔이 사용하는 크리스퍼 단백질은 DNA를 손상시키지 않도록 변이시킨 크리스퍼 단백질이다. 빔의 크리스퍼 단백질은 인식부위의 DNA를 한가닥으로 분리하는 데에서 끝난다.
두번째 도메인인 탈아미노효소(deaminase)는 단일가닥의 DNA에 붙어 근접한 염기의 아민그룹을 가수분해해 염기를 바꿀 수 있다. 탈아미노효소는 염기 중 아민그룹을 가지고 있는 사이토신(Cytosine)과 아데닌(Adenine)을 각각 타이로신(Tyrosine)과 구아닌(Guanine)으로 바꾼다. 빔은 이를 점 돌연변이(point mutation)로 발생하는 유전질환의 치료제로 개발하고 있다.
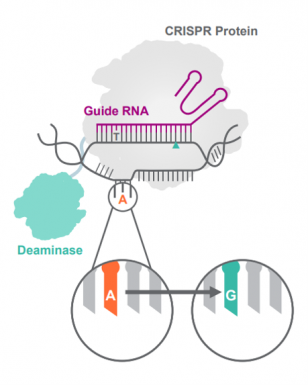
▲빔(Beam therapeutics)의 염기 편집기(base-editor) (빔 발표자료)
빔은 전기천공법(electroporation), LNP(Lipid Nanoparticle), AAV(Adeno-Associated Virus) 벡터 등의 다양한 전달 시스템을 이용해 유전자 편집 기술을 전달하는 파이프라인을 개발중이다. 유전자 치료제의 타깃에 따라 다른 효율이 높은 전달 시스템을 이용하겠다는 의미다.
빔은 전기천공법을 이용해 혈액 및 암 관련 질환 치료제를 개발하고 있다. 'BEAM-101'은 빔의 리드프로그램으로 겸상적혈구병과 베타지중해빈혈에 대한 치료제 후보물질이다. 두 질환은 태아혈색소(Fetal Hemoglobin, HbF)의 발현으로 증상을 완화할 수 있다고 알려져 있다. HbF는 생후 6개월 정도가 지나면 비활성화되는데, BEAM-101은 이와 관련된 유전자인 HBG1/2의 프로모터를 수정해 HbF를 다시 활성화시켜 질환을 치료하는 컨셉이다.
빔은 BEAM-101의 HBG1/2 프로모터 염기 편집 효율이 80% 이상임을 확인했고, HbF의 비율을 염기 편집 전에 비해 6배 이상 높였으며 이에 겸상 적혈구의 비중이 반 이상 줄어든 결과를 발표했다. 존 에반사는 "이러한 결과를 바탕으로 올해 안에 IND를 제출할 예정"이라고 밝혔다.
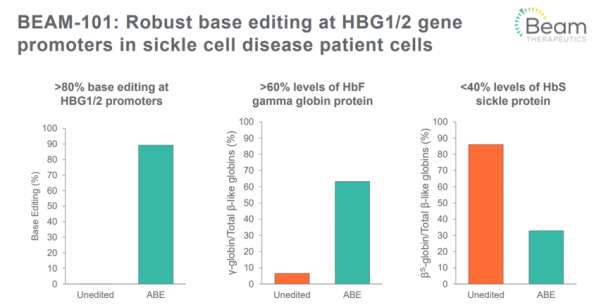
▲BEAM-101 전임상 결과 (빔 발표자료)
그 다음으로 많이 진행된 프로그램인 'BEAM-102' 역시 겸상적혈구병에 대한 치료제 후보물질이다. 하지만 BEAM-102는 BEAM-101과는 다르게 겸상적혈구의 직접적인 원인이 되는 유전자 변이를 타깃으로 한다.
일반적인 베타글로빈(β-globin) 유전자의 특정 타이로신 염기가 아데노신으로 바뀌면 HbS(Sickle β-globin)가 되어 겸상적혈구를 생성한다고 알려져 있다. 같은 위치의 염기가 구아닌인 경우에는 HbG(Makassar β-globin)가 생성되는데, HbG도 정상적인 베타글로빈의 역할을 수행한다. BEAM-102는 HbS를 HbG로 바꿔 겸상적혈구병을 치료하는 기전이다.
존 에반스는 "겸상적혈구 환자의 CD34 세포에 BEAM-102을 처리한 결과 겸상적혈구의 약 80%가 HbG(Makassar)로 바뀌었다"고 설명했다. HbG로 바뀜에 따라 HbS의 비율이 줄어드는 것을 확인했으며 실제 현미경을 통해서 관찰했을 때도 겸상적혈구가 줄어든 것을 확인할 수 있었다.
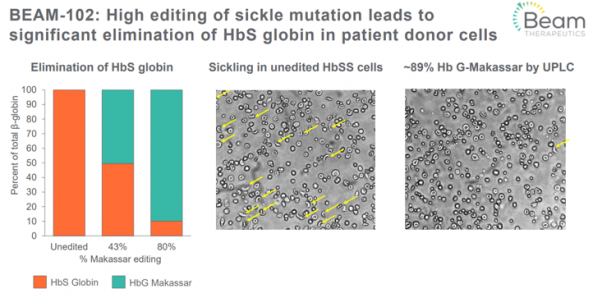
▲BEAM-102 전임상 결과 (빔 발표자료)
그 외에도 빔은 CAR-T 세포의 효율을 높이기 위해 다양한 gRNA를 한번에 처리하는 다중편집(multiplex editing) 기술 'BEAM-201'을 개발하고 있다. 현재 4개의 gRNA를 한번에 도입해 면역거부반응등을 줄인 CAR-T세포를 개발하고 있으며 4개 유전자 동시 편집 효율은 91% 정도로, 존 에반스는 “드라마틱한 결과를 내고 있다”며 “BEAM-102와 BEAM-201은 2021년 IND를 위한 전임상 연구를 진할 것”이라고 밝혔다.
그 외에도 빔은 LNP를 이용한 Alpha-1 antitrypsin(A1AT) 결핍 간질환 치료제, AAV를 이용한 안과 질환 치료제도 개발하고 있다. 염기 편집 치료제 개발을 위해 버브(Verve)및 마젠타(Magenta therapeutics)와 파트너십을 맺고 있으며 임상 및 생산시설과 관련한 파트너십도 맺고 있다고 밝혔다.

















